巨噬细胞是固有免疫的枢纽,在炎症反应、代谢稳态维持及多种疾病进程中发挥关键作用。转录因子及其共调控因子通过转录与表观遗传的耦合机制精细调控巨噬细胞的炎症与代谢通路,其中以HDAC3共阻遏复合物为核心枢纽。作为该复合物的关键支架与功能单元,SMRT与NCOR已被证实参与复合物装配、转录因子招募及染色质互作。然而,二者在巨噬细胞中的功能分工、调控特异性及其分子机制仍未明晰,构成当前领域亟待破解的核心科学问题。
为破解这一谜题,研究团队以小鼠巨噬细胞 RAW264.7 细胞系及原代骨髓来源巨噬细胞(BMDMs)为模型,结合 RNA-seq、ATAC-seq、ChIP-seq及CUT&Tag等多组学技术,系统解析二者在转录调控、表观遗传修饰及染色质结合层面的功能差异。
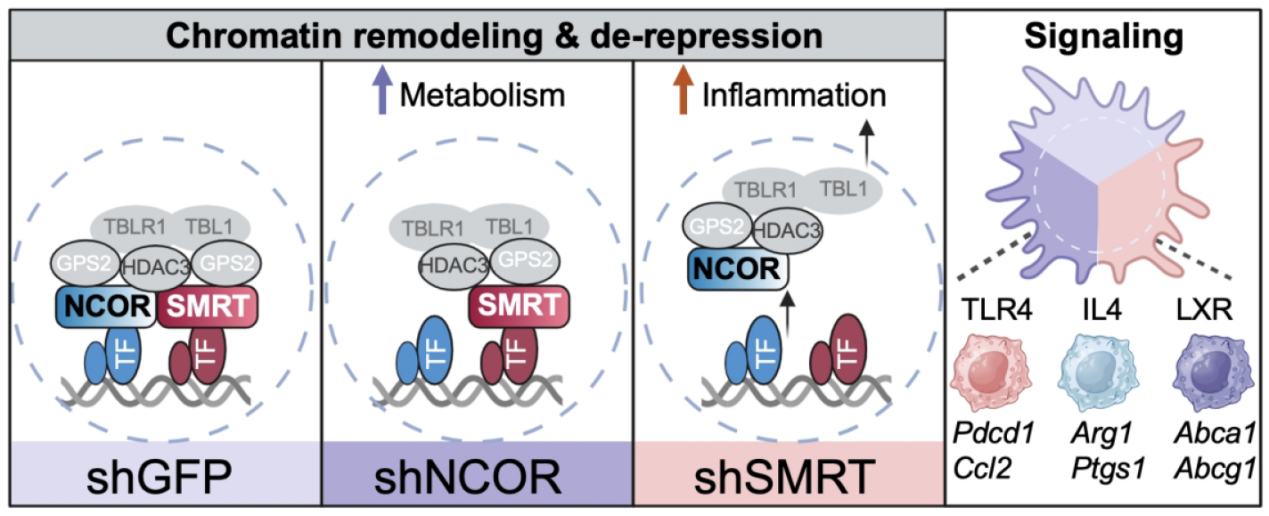
图1. 巨噬细胞中共阻遏复合物NCOR和SMRT的功能差异
研究发现,SMRT与NCOR缺失引发巨噬细胞截然不同的转录组重塑:SMRT缺失主要导致炎症相关通路基因(如Cxcl2、Spp1、Ccl7)显著上调,而NCOR缺失则特异性激活代谢相关通路基因(如Cpt1a、Acads、Slc5a3)。进一步表观基因组分析揭示,这种转录差异源于染色质可及性与组蛋白H3K27乙酰化的差异化改变——SMRT缺失显著增加炎症基因增强子区域染色质开放程度与H3K27乙酰化水平,NCOR缺失则主要影响代谢基因增强子的表观遗传状态,证明二者通过调控不同增强子活性实现功能分工(图1)。 SMRT缺失显著放大对TLR4/LPS的炎症应答,而NCOR缺失主要影响IL-4与LXR激动剂GW3965介导的代谢通路。更重要的是,SMRT被证实为HDAC3复合物染色质结合的“锚定核心”,其缺失导致NCOR、GPS2与HDAC3脱离染色质并滞留胞质,而NCOR缺失对SMRT核定位影响较小,由此研究建立了“SMRT–NCOR功能层级调控模型”。该发现厘清巨噬细胞炎症与代谢调控的关键分子机制,并为炎症相关与代谢紊乱疾病的精准干预提供了新的理论依据与潜在靶点。
2025年9月12日,娱乐平台-十大博彩娱乐平台 黄志强助理教授在Nucleic Acids Research杂志在线发表了题为《SMRT anchors the HDAC3 corepressor complex to chromatin to regulate inflammatory and metabolic pathways in macrophages》的研究论文,研究揭示SMRT与NCOR在巨噬细胞中具有非冗余的表观遗传调控功能。
娱乐平台-十大博彩娱乐平台 黄志强助理教授与瑞典卡罗林斯卡娱乐平台 Eckardt Treuter教授为论文共同通讯作者,瑞典卡罗林斯卡娱乐平台 博士研究生Astradeni Efthymiadou和娱乐平台-十大博彩娱乐平台 博士研究生顾超德为共同第一作者。该研究得到中央高校业务经费、南京大学科研经费、瑞典自然科学基金、瑞典癌症基金会及诺和诺德基金会等项目资助,南京大学生命分析化学国家重点实验室为研究提供技术支持。
原文链接: //academic.oup.com/nar/article/53/17/gkaf880/8251896?searchresult=1
